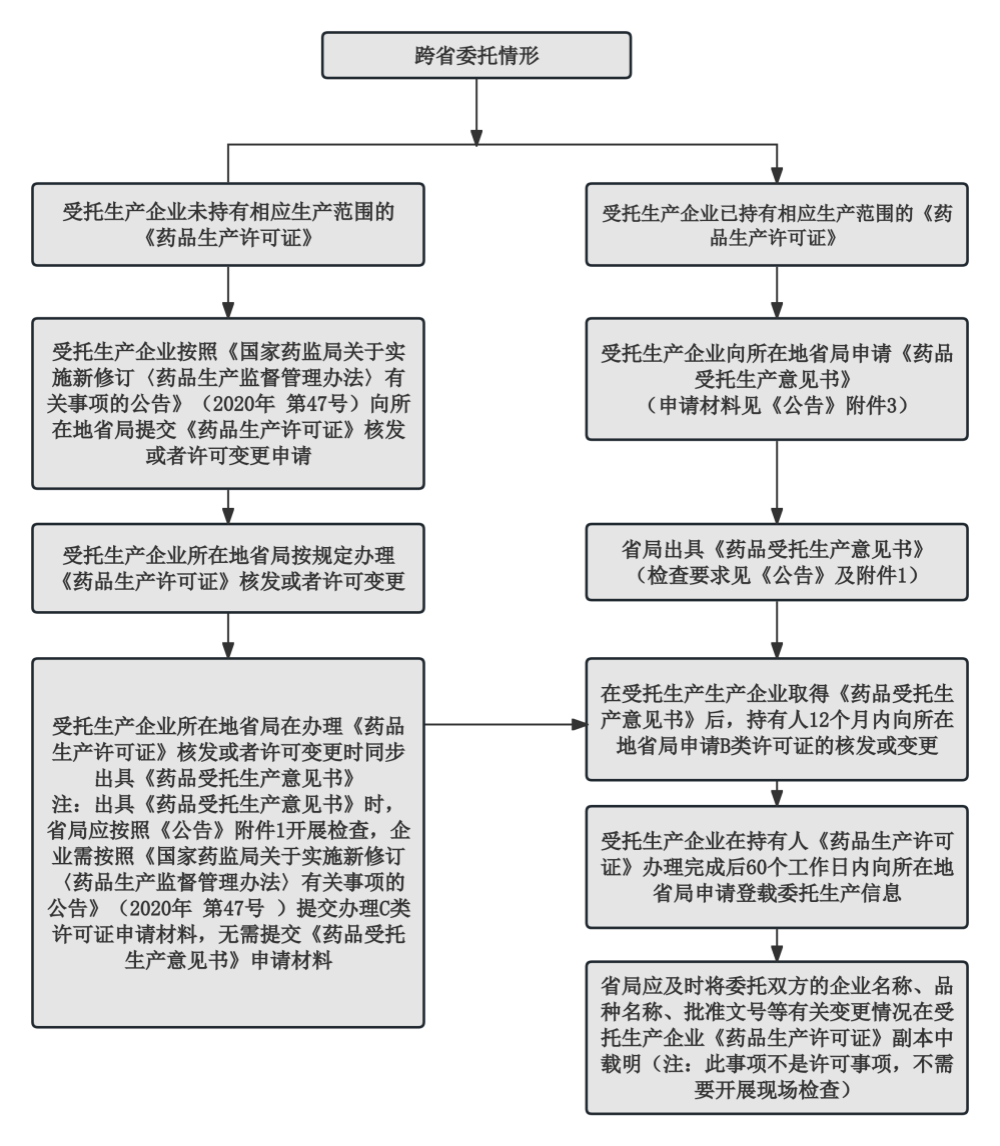
国产新冠口服小分子特效药争夺战,正在争分夺秒地进行着。万众瞩目的国产新冠口服特效药已经进入了上市前最后的冲刺阶段。
虽然后来真实生物出来辟谣,回复媒体此消息不属实,但也再次印证了行业内外对于国产首款口服新冠药物的高度关注和殷切期盼。
一、全球新冠药物研发情况
自新冠疫情全球爆发以来,全球各大制药企业和科研机构一直在致力于开发可有效预防新冠病毒感染的疫苗以及新冠的有效治疗药物。 根据药融云数据统计,截至五月初全球在研新冠药物共有1200余个,IND及以上研发阶段的项目占比近50%,提交上市申请15个,涉及企业1000余家;目前全球已有50余款药物(含疫苗)获批新冠适应症,其中包括12款小分子化药,30余款生物药。 从作用机制上来看,已获批小分子化药中,RdRp抑制剂(RNA以来的RNA聚合酶抑制剂)共有3款,分别为吉利德的瑞德西韦、富山化学的法匹拉韦、默沙东的molnupiravir;此外,还包括辉瑞的3CL蛋白酶抑制剂Paxlovid、COVID19复制酶多蛋白1a抑制剂组合药物奈玛特韦+利托那韦,Incyte的JAK抑制剂巴瑞替尼等。 生物药大类中,作用机制为COVID19刺突糖蛋白调节剂的药物数量占比最高(约为50%);从疗法类型来看,除疫苗以外,中和抗体占多数,包括sotrovimab、卡西瑞单抗+伊德单抗、巴尼韦单抗等,此外,tozinameran、elasomeran、ZyCoV-D等核酸类药物也被批准用于新冠治疗。 目前,全球已上市的新冠口服小分子特效药有两个,默沙东的Molnupiravir和辉瑞的Paxlovid。 国内共上市10余款新冠药物(含疫苗),包括口服药物法匹拉韦、奈玛特韦+利托那韦,中和抗体安巴韦单抗+罗米司韦单抗等,其中多数为紧急使用授权/附条件批准。 相较于需要注射给药的瑞德西韦和中和抗体药物,口服小分子药物具有更多优势,也因此成为了全球新冠药物研发的热门赛道。 新冠口服小分子特效药的优势: ①患者耐受性高,依从性好,便于在患者感染早期就抑制病毒的增殖,避免转化为重症。 ②价格低廉,莫匹那韦在美国的定价为700美元/人,仅为中和抗体的三分之一。 ③便于运输,易于分发。相较于需要静脉注射的抗体药物,口服小分子药物无疑方便许多,在疫情严重、医疗条件落后的不发达国家,口服小分子抗病毒药物更为实际。 从国内企业竞争情况来看,目前国内共有100多家企业参与新冠药物研发,涉及研发项目150余个。国产在研的新冠口服药有阿兹夫定、VV116、普克鲁胺、SIM0417、RAY003等10余款,涉及的上市企业包括君实生物、开拓药业、先声药业、众生药业等。 从药品研发进度看,有6款处于临床试验阶段,其中进程最快的三款为真实生物的阿兹夫定、君实生物的VV116、开拓药业的普克鲁胺。首款国产新冠口服小分子特效药基本锁定在这三款药物中。
- 【研发“超速”的VV16】
- 【未批先火的阿兹夫定】
- 【一波三折的普克鲁胺】
除此之外,仍处于研发早期的在研国产新冠药物还有:前沿生物-U(688221.SH)的FB2001、先声药业(02096.HK)的SIM0417、歌礼制药-B(01672.HK)的ASC10和ASC11、广生中霖/药明康德(603259.SH)的3CL蛋白酶抑制剂、众生睿创的RAY003等。
二、新冠口服小分子特效药市场规模
目前,全球获批上市的新冠口服药物有三款,包括辉瑞的Paxlovid、默沙东的Molnupiravir、君实生物的VV116,近期有获批预期的还有盐野义的S-217622。 据相关数据披露,2022年一季度,默沙东molnupiravi实现收入32亿美元,超过全年预期销售额的一半。2022年,默沙东预期molnupiravir年销售额为50亿-55亿美元。默沙东的Molnupiravir是全球首个新冠口服特效药,在2021年获批不到两个月的时间内实现销售额约 9.5亿美元。2022年截至2月底,默沙东已经在欧洲、东南亚多个地区市场投放了400万个疗程,并承诺今年将在全球完成3000万个疗程投放,对应销售额约60亿美元。而辉瑞2022年一季度,Paxlovid实现收入14.7亿美元,美国市场销售占比69%,低于市场预期的24.20亿美元。辉瑞预测2022年新冠口服药物Paxlovid全年销售为220亿美元。辉瑞Paxlovid是美国首个紧急使用授权的新冠口服药物,于2021年12月获得使用。截至2022一季度,该药在全球获得紧急使用或者有条件使用的国家数量累计已超过60个,可用于非住院、具有发展成重症疾病高风险轻中度新冠患者的治疗,在部分国家也可用于12岁以上的儿童治疗。
结语: 新冠或许会成为长期的流行病,国产新冠口服小分子特效药布局的企业多,上市后还存在医保谈判降价的可能,竞争会比较激烈。未来新冠口服药的竞争或主要集中在有效性、安全性和价格成本等方面。与之同时,国产新冠口服特效药更为重要的意义,或许还有向国际展示中国拥有研制新冠药物的能力。*
本文来源:新浪医药 作者:小编 免责声明:该文章版权归原作者所有,仅代表作者观点,转载目的在于传递更多信息,并不代表“医药行”认同其观点和对其真实性负责。如涉及作品内容、版权和其他问题,请在30日内与我们联系
 客服微v信:
客服微v信:













 京公网安备 11010802031568号
京公网安备 11010802031568号

