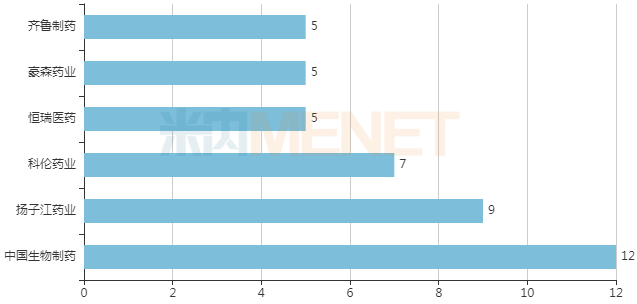
3月2日,KemPharm宣布美国FDA已经批准AZSTARYS(代号:KP415)的新药申请(NDA),每日1次,用于治疗6岁及以上患者的注意力缺陷多动障碍(ADHD)。Corium公司将负责AZSTARYS在美国的商业化。 AZSTARYS由KemPharm专有的LAT(配体激活疗法)技术平台开发,是右哌甲酯(
3月2日,KemPharm宣布美国FDA已经批准AZSTARYS(代号:KP415)的新药申请(NDA),每日1次,用于治疗6岁及以上患者的注意力缺陷多动障碍(ADHD)。Corium公司将负责AZSTARYS在美国的商业化。
AZSTARYS由KemPharm专有的LAT(配体激活疗法)技术平台开发,是右哌甲酯(d-MPH)前药serdexmethylphenidate (SDX)和速释d-MPH组成的一种复方胶囊剂型。AZSTARYS中含有30%立即释放d-MPH和70%延长释放新型SDX。经胃肠道吸收后,SDX转化为d-MPH,并在一天内逐渐释放d-MPH。

serdexmethylphenidate结构
与目前已上市的药物 Vyvanse(二甲磺酸利右苯丙胺胶囊)和Osmotic(盐酸哌甲酯缓释片)相比,AZSTARYS由于包含有速释d-MPH从而具有立即起效的优点。与Adderall XR(安非他明复合盐缓释胶囊)和Focalin XR(盐酸右哌甲酯缓释胶囊)相比,由于SDX是一种前体药物,因此可减少药物依赖。

AZSTARYS与目前已上市ADHD治疗药物比较
一项多中心、双盲、随机、安慰剂对照、III期研究(NCT03292952)评估了AZSTARYS的疗效。该研究共招募了150名6-12岁诊断为ADHD的儿童患者。研究结果显示,与安慰剂组相比,AZSTARYS组患儿症状显著改善,SKAMP-C评分较安慰剂平均降低5.4分。

FDA说明书
由于AZSTARYS中含有d-MPH,是II类管制物质,因此FDA建议AZSTARYS也按照II类管制物质分类。美国缉毒局(DEA)已接受该提案,预计将在90天内给出最终决定。AZSTARYS将于2021年夏季开始销售。
本文来源:医药魔方Plus 作者:小编 免责声明:该文章版权归原作者所有,仅代表作者观点,转载目的在于传递更多信息,并不代表“医药行”认同其观点和对其真实性负责。如涉及作品内容、版权和其他问题,请在30日内与我们联系
 客服微v信:
客服微v信:









 京公网安备 11010802031568号
京公网安备 11010802031568号

