精彩内容 根据美国食品和药物管理局(FDA)数据统计,2021年3月共计批准了5款创新药物,其中,4款创新药物是新分子实体,1款是CAR-T细胞疗法。值得一提的是,距离上一个CAR-T细胞疗法Breyanzi获批上市仅一个月,近两年美国FDA已经批准了3款CAR-T细胞疗法,CAR
精彩内容
根据美国食品和药物管理局(FDA)数据统计,2021年3月共计批准了5款创新药物,其中,4款创新药物是新分子实体,1款是CAR-T细胞疗法。值得一提的是,距离上一个CAR-T细胞疗法Breyanzi获批上市仅一个月,近两年美国FDA已经批准了3款CAR-T细胞疗法,CAR-T细胞疗法领域正式进入收获期,将为细胞免疫行业带来全新机遇。
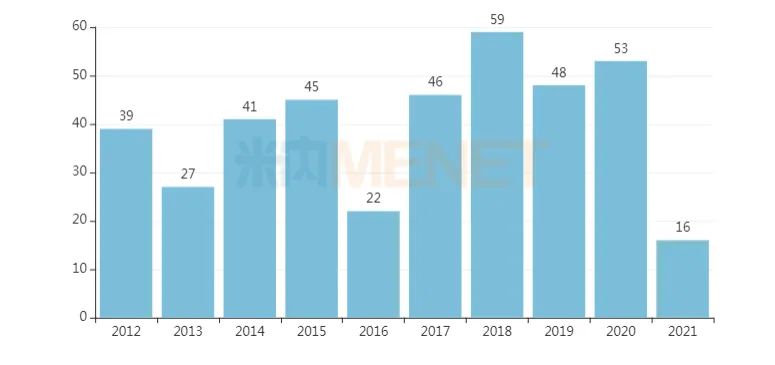
近十年FDA批准的新药数量

来源:FDA网站、公开资料
2021年3月,美国FDA共计批准了5款创新药物,包括治疗注意力缺陷多动障碍含右哌甲酯(d-MPH)前药的新型口服药物Azstarys;治疗复发性或难治性晚期肾细胞癌的Fotivda;FDA批准的第一个也是唯一一个针对已上市口服疗法进行对照研究的口服疾病修正疗法Ponvory;FDA批准的第一个也是唯一一个用于治疗6岁及以上儿童和成人严重低血糖的胰高血糖素类似物;以及首款靶向BCMA用于治疗多发性骨髓瘤患者的CAR-T细胞疗法Abecma。
值得一提的是,距离上一个CAR-T细胞疗法Breyanzi获批上市仅一个月,近两年美国FDA已经批准了3款CAR-T细胞疗法,CAR-T细胞疗法领域正式进入收获期,将为细胞免疫行业带来全新机遇。
来源:FDA网站、米内网全球药物研发库
Azstarys(serdexmethylphenidate ; 右哌甲酯)
2021年3月2日,美国FDA批准KemPharm公司研发的口服药物Azstarys(serdexmethylphenidate ; 右哌甲酯),用于治疗6岁及以上注意缺陷多动障碍(ADHD)患者。Azstarys由速释右哌甲酯(d-MPH)和缓释serdexmethylphenidate(SDX,d-MPH前药)共同组成,通过d-MPH快速释放控制症状,并且SDX经吸收后转化为d-MPH,缓释延长治疗时间,从而实现双重作用。
注意缺陷多动障碍俗称“多动症”,表现为与同龄儿童相比明显的注意力集中困难,注意持续时间短暂,活动过度或冲动的一组综合征。而且症状基本在学前出现,随着年龄的增长,共患学习障碍和其他心理障碍的概率明显增加。
此次批准得到了一项多中心、双盲、随机、安慰剂对照Ⅲ期临床试验结果的支持。该研究在150名6-12岁被诊断为ADHD的儿童中进行,使用评估ADHD症状的量表(SKAMP-C评分)判断用药前后区别,SKAMP-C评分降低代表ADHD症状得到改善。在这项研究中,与接受安慰剂的儿童相比,接受AZSTARYS一次给药的儿童平均SKAMP-C得分降低了5.4分,说明AZSTARYS通过一次给药即可显著改善ADHD症状。
Fotivda(tivozanib)
2021年3月10日,AVEO Pharms公司宣布,其开发的药物Fotivda(tivozanib)正式获得美国FDA批准,用于治疗复发性或难治性晚期肾细胞癌成人患者,且这些患者在既往至少接受过两种全身性疗法治疗。Fotivda此前已获欧盟、挪威、新西兰、冰岛等国家/地区的批准用于晚期肾细胞癌成人患者。
tivozanib具体信息

来源:米内网全球药物研发库
肾细胞癌是泌尿系统中恶性度较高的肿瘤,也是最常见的肿瘤之一,是起源于肾实质泌尿小管上皮系统的恶性肿瘤,占肾恶性肿瘤的80%~90%。据统计,我国肾癌发病率在过去20年间以平均每年6.5%的速度增长,发病率几乎翻了一番。
一项名为TIVO-3的国际多中心关键Ⅲ期临床试验为Fotivda的获批奠定基础。该研究一共纳入了350例复发或难治性晚期肾细胞癌患者,随机分配接受Fotivda或靶向抗癌药Nexavar(sorafenib,索拉非尼)治疗。研究的主要终点为无进展生存期(PFS)。结果显示,患者经过治疗后,与Nexavar组相比,Fotivda治疗组中位无进展生存期(PFS)延长44%(5.6个月 vs 3.9个月);疾病进展或死亡风险降低26%。而且Fotivda组患者的客观缓解率(ORR)为18%,Nexavar组患者则为8%。
Ponvory(ponesimod)
2021年3月18日,FDA宣布批准强生旗下杨森制药Ponvory(ponesimod)上市,用于治疗复发性多发性硬化(MS)成人患者,包括临床孤立综合征阶段、复发缓解型多发性硬化阶段、继发进展型多发性硬化阶段。疾病修正疗法是多发性硬化患者缓解期的标准治疗。Ponvory是FDA批准的第一个也是唯一一个针对已上市口服疗法进行对照研究的口服疾病修正疗法。
ponesimod具体信息

来源:米内网全球药物研发库
多发性硬化是一种以中枢神经系统(CNS)炎性脱髓鞘病变为主要特点的免疫介导性疾病,病变主要累及白质,常见症状包括视力下降、复视、肢体感觉障碍、肢体运动障碍、共济失调、膀胱或直肠功能障碍等。
Ponvory获批的主要基于一项为期两年的Ⅲ期临床试验,该试验比较Ponesimod与国内首个上市的口服疾病修正疗法特立氟胺(teriflunomide)在复发性多发性硬化患者中的疗效、安全性和耐受性。试验结果表示,与特立氟胺组相比,Ponvory治疗组中复发性多发性硬化患者的年复发次数显著减少了30.5%。在试验期间,Ponvory治疗组有71%的患者无确认复发,特立氟胺组有61%的患者无确认复发。同时,试验表明Ponvory还能防止大多数患者的残疾恶化。10例接受Ponvory治疗的患者中,有9例没有出现3个月残疾恶化。
Zegalogue(dasiglucagon)
2021年3月22日,美国FDA批准Zealand Pharma公司的Zegalogue(dasiglucagon)上市,用于治疗6岁及以上的小儿和成年糖尿病患者的严重低血糖症。Zegalogue是第一个,也是目前唯一一个用于治疗上述患者群体严重低血糖的胰高血糖素类似物。
dasiglucagon具体信息

来源:米内网全球药物研发库
严重低血糖症容易导致出现心慌,同时全身无力,或者是有出汗等情况,也容易造成脑缺氧,有一定的危险性的,如果不及时得到救治,容易危及生命。严重低血糖症主要由胰岛素治疗引起的血糖水平严重下降引起,是糖尿病治疗中最令人担心的并发症之一。
Zegalogue的安全性和有效性在一项Ⅲ期,随机,双盲,安慰剂对照的临床试验中得到验证。该试验分为试验A和试验B两部分,试验结果显示,与安慰剂相比,Zegalogue给药后患者血糖的恢复速度更快。试验A和试验B两部分的血糖恢复平均中位恢复时间均仅为10分钟,安慰剂组的恢复时间为30-45分钟。同时,在另一项Ⅲ期成人试验中,99%的患者血糖在15分钟内恢复到了正常水平。
Abecma(idecabtagene vicleucel)
2021年3月26日,FDA批准了百时美施贵宝和蓝鸟生物联合开发的靶向B细胞成熟抗原(anti-BCMA)的嵌合抗原受体(CAR)-T细胞免疫疗法Abecma(idecabtagene vicleucel)上市,用于治疗已经接受过4种及以上前期疗法的复发/难治性多发性骨髓瘤(MM)成年患者。这是首款用于治疗多发性骨髓瘤患者的细胞疗法,也是首款获得批准靶向BCMA的细胞疗法。
idecabtagene vicleucel具体信息

来源:米内网全球药物研发库
Abecma在一项关键性的Ⅱ期临床试验中的优越表现为此次批准奠定基础。共有127名此前至少接受过包括免疫调节剂、蛋白酶抑制剂和抗CD38抗体等3种治疗的复发/难治性多发性骨髓瘤患者参与了此次试验。在接受治疗后可评估疗效的100名患者中,总体的缓解率(ORR)达到了72%,有28%的患者完全缓解,治疗后起效的中位时间是30天,中位持续缓解时间可以长达11个月,而完全缓解的患者,持续缓解的时间超过了1年。
近十年来,CAR-T技术发展迅速,是目前被认为是最有前景的肿瘤治疗方式之一。目前,全球共有5款CAR-T细胞疗法上市,分别为诺华的Kymriah、吉利德的Yescarta和Tecartus,百时美施贵宝的Breyanzi和此次获批的Abecma。CAR-T市场前景广阔,据Coherent Market Insights分析,CAR-T细胞治疗预计在2028年全球市场规模将达到85亿美元,未来的市场空间预计在350亿-1000亿美元。2020年,已进行销售的3款CAR-T产品也取得了不错的销售成绩,全球销售额接近11亿美元。
全球上市的CAR-T细胞疗法

注:资料来源于FDA官网、企业公告、米内网数据库
如有错漏,敬请指正。
本文为原创稿件,转载请注明来源和作者,否则将追究侵权责任。
投稿及报料请发邮件到495903287@qq.com
稿件要求详询米内微信首页菜单栏
商务及内容合作可联系QQ:412539092
本文来源:米内网 作者:皓月 免责声明:该文章版权归原作者所有,仅代表作者观点,转载目的在于传递更多信息,并不代表“医药行”认同其观点和对其真实性负责。如涉及作品内容、版权和其他问题,请在30日内与我们联系
 客服微v信:
客服微v信:








 京公网安备 11010802031568号
京公网安备 11010802031568号

