近日,2022年ASCO年会在美国芝加哥开启。根据ASCO官网摘要信息及各家公司官方发布新闻稿统计显示,2022 ASCO大会上,我国共有超过50家药企的近240项研究中稿,并有19项目入选2022 ASCO大会口头报告,充分体现了我国本土药物研究的含金量和国际学术界认可度。
文丨JOJO
近日,2022年美国临床肿瘤学会(ASCO)年会在美国芝加哥开启。根据ASCO官网摘要信息及各家公司官方发布新闻稿统计显示,2022 ASCO大会上,我国共有超过50家药企的近240项研究中稿,并有19项目入选2022 ASCO大会口头报告,充分体现了我国本土药物研究的含金量和国际学术界认可度。
让我们一起对2022 ASCO上展示的创新项目进行盘点,对标国际前沿,侧重盘点我国创新药企的最新研究。
关键数据出炉,双抗争霸赛一触即发
本次ASCO年会,多种新型治疗模式正向披露最新临床研究成果,双抗、ADC、细胞疗法、小分子抑制剂均有重要推进,指示全球药物最新研发动态。
其中,双抗赛道的竞争尤为明显,又以PD-(L)1×CTLA-4双抗的研究结果最为亮眼。
康方生物的AK104是目前进度最快的一款基于免疫检查点的双抗。在2022 ASCO大会上,康方生物披露了AK104联合标准化一线疗治疗持续性、复发性或转移性宫颈癌(R/M CC)的一项2期临床数据(NCT04868708)。研究结果显示,AK104联合标准治疗方案,在R/M CC患者中具有良好的抗肿瘤活性且耐受性良好。
康宁杰瑞在研的KN046作为靶向PD-1/PD-L1和CTLA-4的双特异性抗体,其相关研究备受瞩目。在本次ASCO年会上报告了KN046应用于肝细胞癌(HCC)的2期研究结果(NCT04542837)。研究结果显示,作为晚期不可切除或转移性HCC患者的一线治疗,KN046联合仑伐替尼在患者ORR和PFS方面表现较好,且安全性可控。研究结果为KN046联合仑伐替尼作为此类患者的潜在治疗新选择提供了证据支持。
齐鲁制药在本次ASCO会议上披露了QL1706疗法的相关数据。QL1706严格意义上不受双特异抗体,而是PD-1和CTLA-4联合疗法(PD-1 IgG4+CTLA4 IgG1),其是利用齐鲁的MabPair组合抗体技术平台。本次披露的数据为QL1706用于晚期鼻咽癌的疗效和安全性:来自1a/1b期试验的汇总队列结果。
除上述双抗外,在PD-L1/TGF-β双抗领域,恒瑞医药、普米斯生物分别公布了SHR-1701、PM8001的早期临床数据;在HER2×HER2双抗领域,百济神州、康宁杰瑞分别公布了Zanidatamab、KN026的早期临床数据。此外,康方生物还公布了PD-1/VEGF双抗AK112的2个早期临床数据、信达生物公布了CD137/PD-1双抗IBI319的数据。
不止胃癌,ADC探索新方向
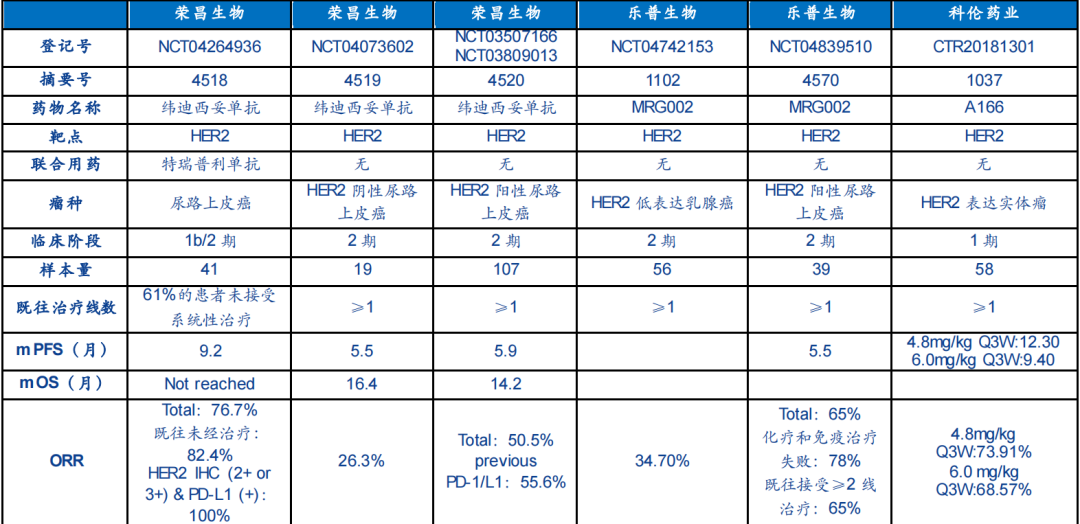
本次ASCO年会上,ADC领域的国内企业报道依旧聚焦在HER2领域,参与的企业有荣昌生物、乐普生物、科伦药业等,但在适应症上,已开始探索新方向,其中主要报道的瘤种为尿路上皮癌(UC)与乳腺癌。
荣昌制药:尿路上皮癌
荣昌制药的维迪西妥单抗,2021年6月9日,成功获批胃癌治疗适应证,成为了我国首个上市的民族原研ADC。仅半年后,2022年1月6日维迪西妥单抗又获得NMPA批准第二个适应症,用于治疗HER2表达的局部晚期或转移性UC,为临床诊疗带来了全新改变。
在2022 ASCO年会上公布维迪西妥单抗有3项临床研究被选中纳入今年壁报讨论环节,且在同一时段构成维迪西妥单抗治疗尿路上皮癌的专题讨论,分别是:1)维迪西妥单抗与特瑞普利单抗联合治疗局部晚期或转移性尿路上皮癌的1b/2期联合研究初步结果;2)维迪西妥单抗在HER2阴性(免疫组化检查结果为0或1+)局部晚期或转移性尿路上皮癌中的2期临床研究;3)维迪西妥单抗治疗HER2过表达(免疫组化检查结果为2+或3+)转移性尿路上皮癌C005、C009临床试验的综合分析。
此外,维迪西妥单抗泛瘤种新治疗模式也亮相了本次大会,即维迪西妥单抗联合放疗与免疫治疗HER2表达晚期难治性实体瘤的研究(布拉格3.0研究)首次公布了初步研究结果。
乐普生物:尿路上皮癌
另外,乐普生物在本次ASCO年会上公布MRG-002在UC适应症的研究结果。在一项单臂、多中心的2期研究中,MRG002的初步结果表明,在经过治疗的HER-2阳性不可切除的局部晚期或转移性UC患者中,MRG002具有一定的疗效,安全性可控,进一步的评估还在进行中。
科伦药业:乳腺癌
科伦药业则积极探索HER2 ADC在乳腺癌中的治疗前景。A166为靶向HER2 ADC药物,通过蛋白酶可裂解连接子将新型毒素分子(Duo-5,微管蛋白抑制剂)定点偶联至HER2抗体(曲妥珠单抗)。A166的1期临床研究数据入选2022 ASCO壁报。试验结论显示:A166既往证明的临床获益、安全性维持不变,在多线经治的HER2阳性转移性乳腺癌患者中,A166具有可控的毒性和值得期待的抗肿瘤活性。
华东医药:卵巢癌
此次ASCO年会上,华东医药将报告其叶酸受体(FRα)ADC药物Mirvetuximab Soravtansine(IMGN853)在FRα高复发性卵巢癌中的2期试验。在该项开放标签、多中心临床研究 (NCT04274426)中,17名患者ORR为71%,中位PFS为15个月,在FRα高表达的亚组中的ORR为80%。目前,该疗法已向FDA申请BLA,前不久被授予优先审评资格,有望成为全球第15款获批上市的ADC药物。
打破内卷,细胞疗法进击实体瘤
经过多年发展,细胞疗法已经成为癌症研究最热门的领域之一,其在血液瘤的治疗中取得的成就尤为振奋人心,让许多肿瘤患者看到了“治愈”的希望。在今年的ASCO会议放出的摘要中,我们看到各大本土biotech药企在实体瘤中的研究成果也频现曙光,成为攻克癌症的又一把利剑。
原启生物:多发性骨髓瘤
原启生物公布了其GPRC5D CAR-T疗法OriCAR-017在复发/难治多发性骨髓瘤患者中进行的首次人体1期研究结果。研究结果显示,OriCAR-017在多发性骨髓瘤患者中显示了良好的安全性和显著的疗效,大部分的AEs是暂时的和可控制的,100%ORR和100%MRD阴性率以及良好的安全性支持OriCAR-017成为一种具有竞争力的治疗方法。值得注意的是,之前BCMA CAR-T治疗复发的患者仍可受益于OriCAR-017。
亘喜生物:多发性骨髓瘤
GC012F是一款BCMA/CD19双靶点CAR-T产品,最新数据显示,该疗法完全缓解率近100%。该候选产品依托于亘喜生物专有的FasTCAR平台技术,具备“次日完成生产”的优势,于2021年11月被美国FDA授予孤儿药资格认定,用于治疗多发性骨髓瘤。
在本次ASCO会议上,亘喜生物带来了一项在复发性/难治性多发性骨髓瘤患者中评价BCMA/CD19双靶向自体CAR-T细胞疗法GC012F的多中心、首次人体研究的更新结果。研究结果显示:截至2022年1月26日,28例患者接受了疗效评估,中位随访时间为6.3个月(范围1.8-29.9个月);目前,该研究仍在对患者进行持续随访,以评估缓解深度。
斯丹赛:结直肠癌
斯丹赛基于自主研发的CoupledCAR®平台技术构建了靶向GUCY2C的CAR-T细胞疗法GCC19CART,用于治疗复发/难治性结直肠癌(R/R mCRC)患者。2021年8月获得了美国FDA的临床试验批件,并于2022年4月获得FDA授予的快速通道资格。
在此次ASCO会议上,斯丹赛将报告GCC19CART中国IRB临床试验中2个剂量爬坡试验组纳入的21例受试者的数据。截至2022年5月3日,13名受试者被纳入1级剂量组(1x10^6 cells/kg),8名受试者被纳入2级剂量组(2x10^6 cells/kg)。两种剂量水平的总体客观缓解率(ORR)为28.6%;3个月内疾病控制率(DCR,即使用药物后,肿瘤的体积不再增长)为100%。
科济药业:胃癌
科济药业开发了全球首个针对Claudin18.2的CAR-T细胞疗法--CT041。今年5月,CT041疗法最新1期试验中期结果在《Nature Medicine》在线发表,结果显示CT041具有显著的疗效和出色的耐受性,代表着中国团队率先攻破了CAR-T疗法在实体瘤中的瓶颈。
在本次ASCO会议上,科济药业将进一步发布CT041治疗晚期胃癌/胃食管结合部腺癌的1b/2期研究结果和针对胰腺癌的1b期数据。值得一提的是,临床试验入组患者是“既往接受过至少二线治疗失败的Claudin18.2表达阳性的晚期胃癌/食管胃结合部腺癌(GC/GEJ)”,属于临床上难以治疗的晚期患者。
香雪制药:软组织肉瘤
香雪制药拥有高亲和力TCR-T技术,并基于技术开发出了TCR-T细胞治疗产品TAEST16001。其1期临床试验入选了今年ASCO会议的口头报告。该临床试验是一项开放、单臂、剂量递增和扩展研究,旨在评估TAEST16001在软组织肉瘤患者中的安全性、耐受性、PK、PD和初步疗效。结果显示,在12例疗效可评估的患者中,5例部分缓解,5例疾病稳定,2例疾病进展,总体响应率为41.7%。总体而言,TAEST16001表现出可接受的耐受性,支持该产品在晚期软组织肉瘤中的持续扩增研究。
新兴免疫靶点标志新方向
近年来,PD-1、PD-L1的“内卷”已经进入尾声,其他新兴肿瘤免疫靶点成为“新大陆”。在本次ASCO年会,我们发现国内biotech公司在BTLA、LAG-3、CD73等新靶点上更新了最新临床数据。
君实生物:BTLA
B和T淋巴细胞衰减子(BTLA)作为一种免疫检查点分子,与其他免疫检查点分子如PD-1和CTLA-4具有类似的结构和相近的细胞内的信号传导机制;其不仅在T细胞表面表达,同时也在B细胞、NKT细胞和树突状细胞中表达,通过与其配体结合传递抑制信号,在机体的免疫调控中发挥负调控作用。
2022 ASCO年会上,君实生物公布了其自主研发的靶向BTLA的重组人源化IgG4单克隆抗体Icatolimab(TAB004/JS004),单药治疗晚期实体瘤患者的1a期剂量递增研究结果,以及单药或与特瑞普利单抗联合治疗复发/难治性淋巴瘤的1期研究结果。研究结果显示:Icatolimab单一疗法在所有评估的剂量中均具有良好的耐受性,并显示出作为单一疗法的初步临床疗效。Icatolimab联合toripalimab(抗PD-1)用于治疗晚期实体瘤患者目前正在进行中。Icatolimab单独或与toripalimab联合在所有评估的剂量中均具有良好的耐受性,并在复发/难治性淋巴瘤患者中显示出初步的临床疗效。
信达生物:LAG-3
IBI110是信达生物研发的重组全人源抗LAG-3单克隆抗体。继去年ASCO上首次发布了IBI110的1a/1b期临床数据,信达在今年ASCO年会上发布更新数据,并公布在两个癌种上的1b期临床初步数据:胃及胃食管交界处癌、鳞状非小细胞肺癌。试验结论显示:IBI110单药或联合信迪利单抗均表现出可接受的安全性和值得期待的抗肿瘤活性。
维立志博:LAG-3
LBL-007是由维立志博自主研发的一种IgG4亚型全人源单克隆抗体。在今年ASCO年会上,维立志博公布了LBL-007联合君实生物PD-1单抗特瑞普利单抗治疗不可切除或转移性黑色素瘤的1期临床结果。公开的摘要数据显示,LBL007与特瑞普利单抗联合用药在不可切除或转移性黑色素瘤患者中具有良好的耐受性和有希望的疗效,尤其是在未接受抗PD-(L)1治疗的肢端型黑色素瘤患者中。
天境生物:CD73
在2022 ASCO年会上,天境生物公布了CD73抗体尤莱利单抗与特瑞普利单抗联用治疗非小细胞癌(NSCLC)2期临床积极数据,并预计于2023年启动3期临床研究。
数据显示:尤莱利单抗单药治疗或联合治疗均展现出良好的安全性和耐受性,未观察到剂量限制性毒性(DLT)事件。在一组不适合标准治疗的晚期NSCLC患者中观察到积极的疗效信号。临床数据证实疗效反应与肿瘤的CD73表达高度相关,进一步提示CD73可作为预测性生物标志物。此外,天境生物还公布了截至2022年3月29日最新的2期临床研究数据。最新数据显示,在三组治疗情况不同的NSCLC患者队列中,在一组不适合标准治疗的晚期NSCLC(大部分处于肺癌四期)患者中观察到了积极的疗效信号。
启 示
近几年,政策刺激下资本涌入,国内迎来创新大风口。在良好的政策环境与资本推动下,国内创新崛起加速。国产创新药陆续进入收获期,未来几年将看到更多重磅创新产品在国内陆续获批上市。但不可忽视的是,政策给予“泛泛创新”的时间窗口越来越短,医保控费趋严、赛道日益拥挤,行业已经慢慢进入到“精选优质创新”的时刻。未来同质化竞争将持续白热化,同质化产品将逐渐失去竞争力,而新技术、稀缺的技术平台、差异化的治疗领域、创新地给药方式等都可能会给企业带来更好的竞争格局,有技术沉淀的公司有望脱颖而出。
*本文来源:药智 作者:小编 免责声明:该文章版权归原作者所有,仅代表作者观点,转载目的在于传递更多信息,并不代表“医药行”认同其观点和对其真实性负责。如涉及作品内容、版权和其他问题,请在30日内与我们联系
 客服微v信:
客服微v信:








 京公网安备 11010802031568号
京公网安备 11010802031568号

