2020年,国家药品监督管理局(NMPA)共批准16种肿瘤新药。基于医药魔方NextPharma数据库、NextMed数据库、2020版新型抗肿瘤药物临床应用指导原则及公开信息,医药魔方Med特别推出“肿瘤新药数据卡”,为大家介绍国内上市肿瘤新药的一些关键信息,供大家参考。
2020年,国家药品监督管理局(NMPA)共批准16种肿瘤新药。基于医药魔方NextPharma数据库、NextMed数据库、2020版新型抗肿瘤药物临床应用指导原则及公开信息,医药魔方Med特别推出“肿瘤新药数据卡”,为大家介绍国内上市肿瘤新药的一些关键信息,供大家参考。
普拉曲沙

Q1
基本信息
普拉曲沙(Folotyn)由Allos Therapeutics公司开发,是首个用于治疗外周 T 细胞淋巴瘤 (PTCL)的二氢叶酸还原酶抑制剂(DHFR),最早于2009年9月获得FDA批准上市,商品名为Folotyn。

2012年4月,Spectrum公司以2.06亿美元收购该公司获得这款药物。2019年,该公司又以3亿美元的价格将这款药物出售给印度药企阿拉宾度子公司Acrotech Biopharma。
该药以优先审评方式于2020年8月26日获NMPA批准上市。

Q2
上市背景
外周T细胞淋巴瘤(PTCL)是一组起源于胸腺后成熟T细胞或NK/T细胞的高度异质性的侵袭性非霍奇金淋巴瘤(NHL),占欧美全部非霍奇金淋巴瘤的10%,但是这个比例在亚洲人群中高达24%。据估计,我国PTCL每年新增患者大约为1.31-1.57万人。

目前,医药魔方Nextpharma共收录了8个PTCL治疗药物,包括西达本胺、维布妥昔单抗、普拉曲沙、贝林司他、mogamulizumab、克唑替尼、罗米地辛和呋咯地辛。其中,西达本胺(微芯生物)和维布妥昔单抗(武田)已经在中国获批。
微芯生物西达本胺于2014年12月在中国获批上市,用于治疗PTCL,2019年12月,西达本胺治疗乳腺癌的适应症在中国获批。微芯生物2020半年报显示,西达本胺已惠及近万名淋巴瘤患者,累计销售额超过6亿元。
Q3
适应症
普拉曲沙在中国获批的适应症为:复发、难治的外周 T 细胞淋巴瘤 (PTCL)患者的治疗。

DHFR适应症研发布局
Q4
治疗费用
目前,Folotyn中国上市价格还未正式公布。
Folotyn尚未进入国家医保目录。
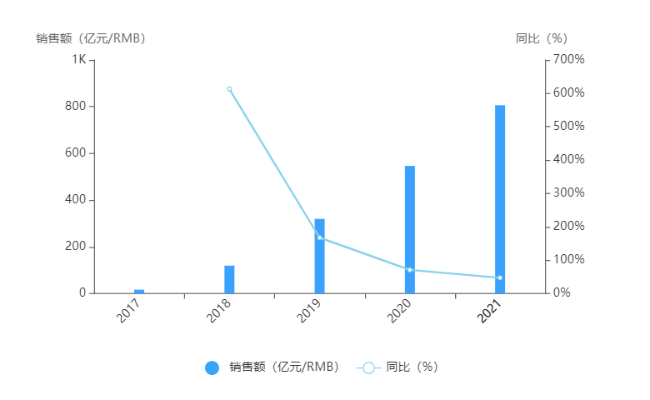
财报显示,Folotyn在2018年的销售额为4800万美元。

销售图表
Q5
循证数据及核心临床
II期PROPEL研究结果显示,111例复发/难治PTCL患者使用普拉曲沙单药治疗,ORR为29%,普拉曲沙基于此成为首个获批上市治疗复发/难治PTCL的药物。

该研究纳入的主要是白人和非裔美国人,亚洲人较少。而在日本和中国复发/难治PTCL患者的研究者,可观察到普拉曲沙的ORR为45%和52%。

在治疗复发/难治PTCL时,单药普拉曲沙与罗米地辛、贝利司他、西达本胺效果相似,且在不同亚型的治疗中各有优劣。

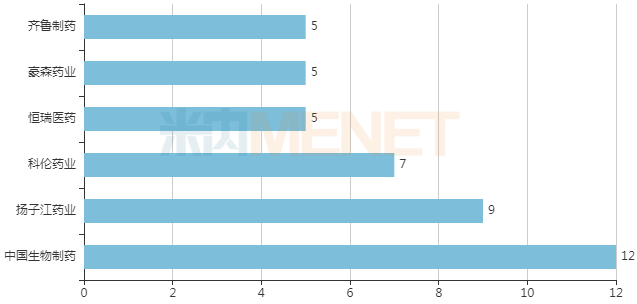
Folotyn核心临床布局
数据来源:NextClinTrial数据库,仅保留以药品注册,或者以变更指南为目的的关键临床试验;排除低质量的研究者发起研究、或者药企开展的探索性质的早期临床
Q6
指南推荐
CSCO淋巴瘤诊疗指南(2020版)
复发难治PTCL患者的治疗


复发难治PTCL患者首选参加临床试验。多个研究证实部分挽救化疗方案在复发难治PTCL患者中的作用,但没有前膽性对照研究证实哪种方案更优。对于不符合移植条件的患者,根据患者身体条件选择是否给予强烈方案化疗(如DHAP,ESHAP,GDP,GemOx,ICE等)。
一些新药的出现为这部分患者带来希望。西达本胺是一种新型口服组蛋白去乙酰化酶抑制剂,研究结果显示其可改善复发难治PTCL患者的生存。普拉曲沙通过抗叶酸发挥抗肿瘤作用,Il期研究结果显示能够改善既往接受多种化疗方案治疗患者的生存。另外一项前瞻性期研究证实烷化剂苯达莫司汀也对部分复发难治PTCL患者有效。免疫调节剂来那度胺在复发难治PTCL中也显示初步疗效。小样本量研究证实ALK抑制剂克唑替尼能够有效治疗ALK阳性淋巴瘤。另外一项小样本量研究认为蛋白酶体抑制剂硼替佐米可能对复发难治PTCL患者有效。对于敏感复发/进展患者,若有合适供者,推荐选择allo-SCT。若无合适供者,可选择ASCT。
本文来源:医药魔方Plus 作者:小编 免责声明:该文章版权归原作者所有,仅代表作者观点,转载目的在于传递更多信息,并不代表“医药行”认同其观点和对其真实性负责。如涉及作品内容、版权和其他问题,请在30日内与我们联系
 客服微v信:
客服微v信:








 京公网安备 11010802031568号
京公网安备 11010802031568号

