精彩内容 6月18日,CDE官网显示,恒瑞1类新药海曲泊帕乙醇胺片的上市申请已获承办。同日,恒瑞医药发布公告称,公司向美国FDA申报的盐酸右美托咪定氯化钠注射液简略新药申请(ANDA)已获得批准。 $14亿大品种!恒瑞1类新药申报上市 资料显示,同类产品艾曲泊
【获批】浙江药企搅局20亿大品种,辉瑞六成市场岌岌可危?
精彩内容 6月17日,国家药监局官网显示,浙江杭康药业的注射用帕瑞昔布钠以仿制4类申报获批上市,视同通过一致性评价,在此之前,成都百裕制药是首家过评企业。米内网数据显示,2019年中国公立医疗机构终端帕瑞昔布注射剂销售额近20亿元。 资料显示,帕瑞昔布...
精彩内容
6月18日,CDE官网显示,恒瑞1类新药海曲泊帕乙醇胺片的上市申请已获承办。同日,恒瑞医药发布公告称,公司向美国FDA申报的盐酸右美托咪定氯化钠注射液简略新药申请(ANDA)已获得批准。
$14亿大品种!恒瑞1类新药申报上市

资料显示,同类产品艾曲泊帕(Eltrombopag,PROMACTA®)是葛兰素史克公司研发的非肽类TPO-R激动剂,最早于2008年获美国FDA批准上市,目前该品种已在全球100多个国家批准上市。2018年7月,诺华中国宣布艾曲泊帕在中国获批上市,商品名为瑞弗兰®,用于特发性血小板减少性紫癜(ITP)患者。
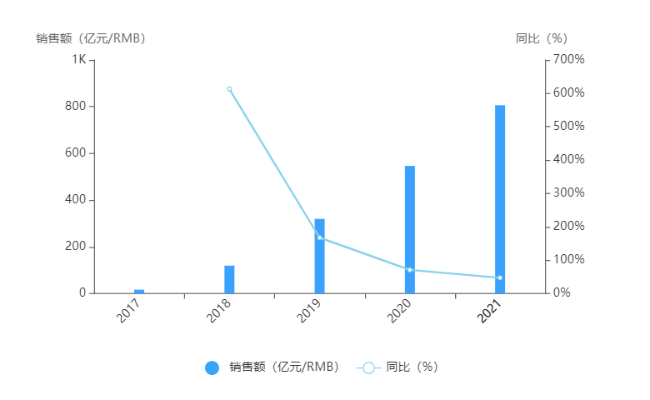
诺华艾曲泊帕全球销售情况(单位:百万美元)

显示,2019年艾曲泊帕全球总销售额14.16亿美元。据了解,为了寻找更加高效、低毒的TPO-R激动剂,恒瑞医药对艾曲泊帕进行了一系列结构的修饰,研究开发具有自主知识产权的1类创新药:高选择性TPO-R激动剂海曲泊帕乙醇胺片。
盐酸右美托咪定氯化钠注射液ANDA获批
同日,恒瑞医药发布公告称,公司向美国FDA申报的盐酸右美托咪定氯化钠注射液简略新药申请(ANDA,即美国仿制药申请,申请获得美国 FDA审评批准意味着申请者可以生产并在美国市场销售该产品)已获得批准。
【关注】布局国际化!这家A股药企巨亏10亿后进军H股
精彩内容 科创板的硬科技“名片”吸引了港股公司,与此同时,有科创企业出于国际化战略布局的考虑向港股市场迈进。登陆科创板近4个月时间,国产创新药企业百奥泰就着手筹划H股上市进程。 百奥泰16日晚公告,公司董事会审议通过《关于公司发行H 股股票并在香港...
药品基本情况

资料显示,盐酸右美托咪定氯化钠注射液是一种相对选择性α 2-肾上腺素受体激动剂,适 用于外科手术和其他手术之前或手术期间非插管患者的镇静。盐酸右美托咪定氯化钠注射液由Hospira Inc.开发,最早于2013年在美国获批,商品名为Precedex。目前国外已有7家企业的盐酸右美托咪定氯化钠注射液仿制药获批上市,另有3款其他规格的盐酸右美托咪定注射液(100ug/ml)在美国获批。
近年中国公立医疗机构终端右美托咪定注射剂销售情况(单位:万元)
米内网数据显示,2019年中国公立医疗机构终端右美托咪定注射剂销售额高达35.99亿元。国内已有江苏恒瑞医药、辰欣药业、江苏恩华药业等企业的盐酸右美托咪定注射液(100ug/ml)获批,但尚无本次公司所获批准所涉浓度的盐酸右美托咪定氯化钠注射液获批,目前暂无国外盐酸右美托咪定氯化钠注射液进入中国。
恒瑞医药表示,本次盐酸右美托咪定氯化钠注射液获得美国FDA批准文号标志着公司具备了在美国市场销售该药品的资格,对市场拓展带来积极影响,公司将积极推动该药品的上市销售。截至目前,公司在该产品研发项目上已投入研发费用约5236万元。
米内网 白羽 整理
来源:CDE官网、米内网数据库、上市公司公告
投稿及报料请发邮件到495903287@qq.com
稿件要求详询米内微信首页菜单栏
商务及内容合作可联系QQ:412539092
28款注射剂将集采!恒瑞、扬子江……重磅品种被盯上,10省份集采“掀”降价大潮
精彩内容 近日,省级带量采购如火如荼,青海正式公布59个集采品种,山西21个注射剂中标结果确定,山东计划7月启动40个品种集采……米内网数据显示,山东40个带量采购品种(105个品规)2019年在中国公立医疗机构终端销售额超过10亿元的有32个;非过评品种占比...
本文来源:米内网 作者:小编 免责声明:该文章版权归原作者所有,仅代表作者观点,转载目的在于传递更多信息,并不代表“医药行”认同其观点和对其真实性负责。如涉及作品内容、版权和其他问题,请在30日内与我们联系
 客服微v信:
客服微v信:








 京公网安备 11010802031568号
京公网安备 11010802031568号

