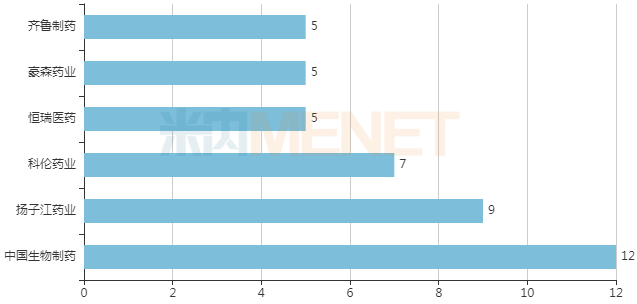
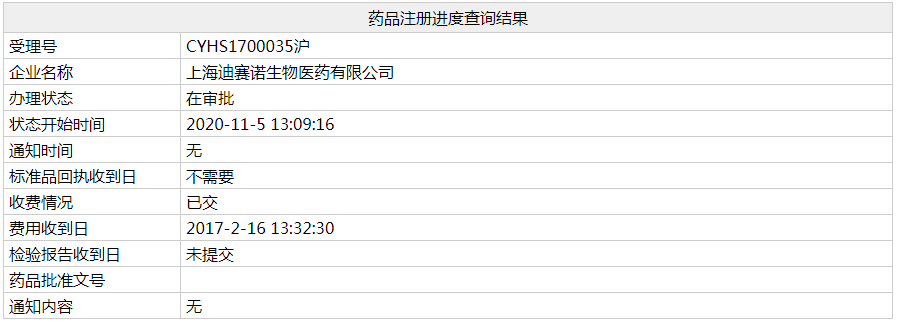
11 月 4 日,CDE 官网显示,百济神州「迪妥昔单抗」上市申请获承办。此前于 9 月 29 日,迪妥昔单抗公示拟纳入优先审评,现已正式纳入,其适应症为神经母细胞瘤。 迪妥昔单抗(Dinutuximab beta)是一款单克隆抗体,可与神经母细胞瘤细胞上过度表达的一个 GD2
11 月 4 日,CDE 官网显示,百济神州「迪妥昔单抗」上市申请获承办。此前于 9 月 29 日,迪妥昔单抗公示拟纳入优先审评,现已正式纳入,其适应症为神经母细胞瘤。
迪妥昔单抗(Dinutuximab beta)是一款单克隆抗体,可与神经母细胞瘤细胞上过度表达的一个 GD2 的特定靶点结合。它于 2017 年获得欧盟委员会批准,治疗 1 岁以上的接受过诱导化疗并达到部分缓解的高危神经母细胞瘤患者,随后进行清髓性治疗和干细胞移植,或者复发或难治性神经母细胞瘤的患者。在复发/难治性患者以及接受一线疗法并未达到完全缓解的患者中,dinutuximab beta 应与白细胞介素-2(IL-2)联用。
2020 年 1 月 13 日,EUSA Pharma(以下简称 EUSA)与百济神州宣布双方就孤儿生物制剂药物 SYLVANT®(司妥昔单抗)及 QARZIBA®(dinutuximab beta)在大中华地区达成独家开发和商业化协议。
值得一提的是,迪妥昔单抗是欧洲药品管理局(EMA)唯一批准的用于治疗高危神经母细胞瘤的靶向肿瘤免疫疗法。神经母细胞瘤是一种具有侵袭性赘生物,是儿童中最常见的起源于脑外的实体瘤。
本文来源:insight数据库 作者:加一
免责声明:该文章版权归原作者所有,仅代表作者观点,转载目的在于传递更多信息,并不代表“医药行”认同其观点和对其真实性负责。如涉及作品内容、版权和其他问题,请在30日内与我们联系


 客服微v信:
客服微v信:








 京公网安备 11010802031568号
京公网安备 11010802031568号

