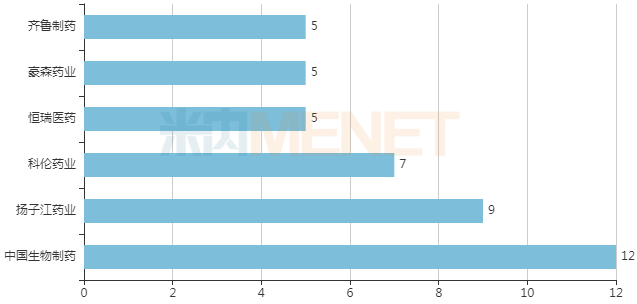
总额 1.39 亿美元!恒瑞 PD-L1/TGF-β 双抗授权给韩国东亚公司
11 月10 日,恒瑞医药发布公告称将自主研发且具有知识产权的 SHR-1701(PD-L1/TGF-β RII 抗体)项目有偿许可给东亚公司,东亚公司将获得其在韩国的独家临床开发、生产和市场销售的权利。东亚公司被许可在韩国开发 SHR-1701 用于治疗所有人类疾病的权利。 SHR
11 月10 日,恒瑞医药发布公告称将自主研发且具有知识产权的 SHR-1701(PD-L1/TGF-β RII 抗体)项目有偿许可给东亚公司,东亚公司将获得其在韩国的独家临床开发、生产和市场销售的权利。东亚公司被许可在韩国开发 SHR-1701 用于治疗所有人类疾病的权利。

SHR-1701 为恒瑞自主研发且具有知识产权的程序性死亡配体 1(PD-L1)/转化生长因子-β II 型受体(TGF-β RII)抗体。目前已启动多项临床研究。

截至目前,该产品已投入研发费用约为 10,869 万元人民币。目前 Merck KGaA 公司的同类产品 M7824 在国内外处于临床试验阶段,适应症以晚期恶性肿瘤为主。国内外尚无同类靶点产品获批上市,亦无相关销售数据。
交易对方基本信息
DONG-A ST CO., LTD.公司于 1932 年成立,总部位于韩国首尔。东亚公司是韩国上市公司,证券代号:170900(KRX)。东亚公司是一家专业从事医药产品和医疗器械的研发、生产和销售的企业,提供各种处方药、生物制剂和生物仿制药。东亚公司拥有强大的肿瘤研发部门,包括免疫肿瘤学和表观遗传学管线。
截至 2019 年 12 月 31 日,东亚公司及其子公司的资产合计 10,088 亿韩元(约 59.5 亿人民币),负债合计为 3,629 亿韩元(约 21.3 亿人民 币),股东权益合计为 6459 亿韩元(约 37.9 亿人民币)。2019 年东亚 公司及其子公司的营业收入为 6123 亿韩元(约 36.0 亿人民币),净利润 为 709 亿韩元(约 4.16 亿人民币)。
1、许可范围
恒瑞将自主研发且具有知识产权的 SHR-1701(程序性死亡配体 1 (PD-L1)/转化生长因子-β II 型受体(TGF-β RII)抗体)项目有偿许可给东亚公司,东亚公司将获得其在韩国的独家临床开发、生产和市场销售的权利。东亚公司被许可在韩国开发 SHR-1701 用于治疗所有人类疾病的权利。
2、财务条款
(1)首付款协议签订 30 天内,东亚公司将向恒瑞支付 229 万美元的首付款。
(2)研发及上市里程碑付款、生产技术转移付款
当 SHR-1701 在韩国第一个 II 期临床试验成功时,东亚公司将向恒瑞支付 169 万美元里程碑款;当 SHR-1701 在韩国胰腺癌适应症 III 期临床试验成功和以胰腺癌适应症获批上市时,东亚公司将向恒瑞分别支付 169万美元里程碑款;SHR-1701 在韩国拓展一个新的适应症,其 III 期临床试验成功和获批上市时,东亚公司将向恒瑞支付不同额度的里程碑款。东亚公司将向恒瑞支付不超过 846 万美元的研发及上市里程碑款、生产技术转移款。东亚公司将承担自协议生效起 SHR-1701 在韩国境内的临床开发费用(包括恒瑞的国际多中心研究)。
(3)销售里程碑付款 从 SHR-1701 在韩国启动商业销售开始,东亚公司将根据实际年净销售额向恒瑞支付累计不超过 1.285 亿美元的里程碑款。
(4)销售提成 从 SHR-1701 在韩国启动商业销售开始,东亚公司将按照约定比例从 其年净销售额中向恒瑞支付销售提成,提成比例为 10%。销售提成期为(1) 从东亚公司首次商业销售许可产品起满 20 年,或(2)许可区域内失去有 效专利保护,二者之中较晚的时间点。
公告显示,2019 年韩国医药市场规模为 159.5 亿美元(约 1127.6 亿人 民币),占全球医药市场的 1.4%。本协议的签署有助于拓宽 SHR-1701 的海外市场,为韩国患者提供优质的治疗选择,也将进一步提升公司创新品牌和海外业绩。另外,这是今年恒瑞医药向海外输出的第三个创新药,是公司创新药国际化进程的又一次突破性进展,将进一步提升公司创新品牌和海外业绩。
来源:恒瑞公告

点击阅读原文
免费试用 Insight 数据库
本文来源:insight数据库 作者:小编 免责声明:该文章版权归原作者所有,仅代表作者观点,转载目的在于传递更多信息,并不代表“医药行”认同其观点和对其真实性负责。如涉及作品内容、版权和其他问题,请在30日内与我们联系
 客服微v信:
客服微v信:








 京公网安备 11010802031568号
京公网安备 11010802031568号

